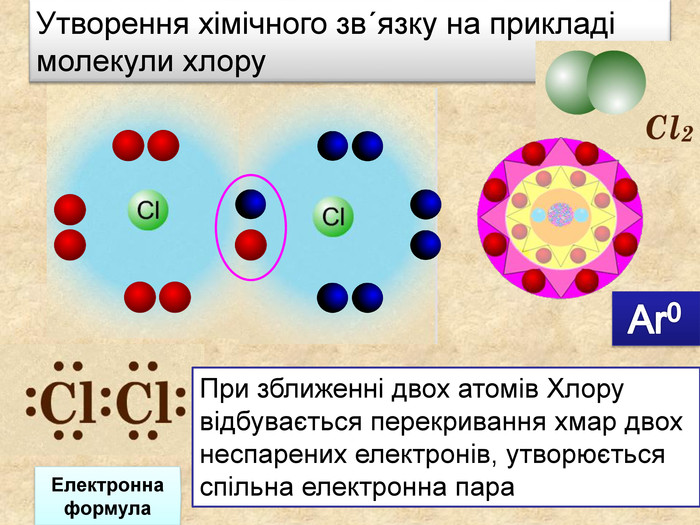
Скільки спільних електронних пар виникає у молекулі хлору?
Сучасна хімія надає чітке розуміння того, скільки спільних електронних пар виникає у молекулі хлору, завдяки дослідженням будови молекул і типів хімічних зв’язків. Молекула хлору (Cl2) є прикладом неполярного ковалентного зв’язку, де два атоми хлору об’єднуються, утворюючи одну спільну електронну пару. Це характерне явище для молекул галогенів, які часто зустрічаються в природі та численних промислових застосуваннях. Розглянемо детальніше природу та характеристики цього зв’язку.
Ковалентний зв’язок і його природа
- Типи ковалентних зв’язків:
- Полярні
- Неполярні
- Неполярний ковалентний зв’язок: формуються між атомами, які мають однакову або дуже схожу електронегативність.
У молекулі хлору ковалентний зв’язок є неполярним, оскільки обидва атоми є атомами того самого елемента з однаковою електронегативністю.
Механізм утворення молекули Cl2
Молекула хлору утворюється завдяки обміну електронами між двома атомами хлору. Кожен атом хлору має сім електронів на зовнішньому електронному рівні, тому йому не вистачає лише одного електрона для досягнення стабільної електронної конфігурації благородного газу (аргону).
| Характеристика | Опис |
|---|---|
| Зовнішній електронний шар | 7 електронів |
| Потреба для стабільності | 1 електрон |
Таким чином, два атоми хлору діляться по одному електрону, утворюючи одну спільну електронну пару. Це забезпечує кожному атому хлору повну октаедричну конфігурацію.
Графічне представлення
Відомий спосіб продемонструвати формування ковалентних зв’язків — це графічне зображення електронної структури:
Cl • + • Cl → Cl : Cl
У наведеній схемі кожна точка (•) представляє валентний електрон. Коли два атоми хлору об’єднуються, кожен поділяє свій поодинокий електрон, що знаменується в графічній моделі спільною парою (:) між ними.
Заключні думки
Розуміння таких базових концепцій, як питання “скільки спільних електронних пар виникає у молекулі хлору”, є ключем до глибшого осягнення хімічних процесів, що відбуваються на молекулярному рівні. Молекула Cl2 — це простий, але прекрасний приклад того, як атоми взаємодіють для досягнення стабільної конфігурації, формуючи одну спільну електронну пару, яка приносить кожному атому хлору стабільність і знижує загальний енергетичний стан системи.